Diplôme universitaire
La plus grande faculté vétérinaire du monde”
Présentation
La demande de professionnels compétents, capables de s'occuper des oiseaux, augmente chaque jour. Spécialisez-vous dans ce domaine grâce à ce Mastère Spécialisé Hybride"
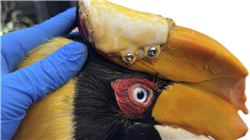
Les oiseaux, généralement des espèces sauvages, peuvent souffrir de divers troubles lorsqu'ils tentent de s'adapter à un environnement domestique ou subir des blessures dans leur habitat naturel pour des raisons de survie. Il est donc important de connaître et de comprendre des facteurs tels que l'alimentation, le comportement, l'anatomie et la physiologie En outre, la prise en charge médicale de ces animaux est souvent compliquée et nécessite des connaissances spécifiques pour les manipuler correctement.
En partant de ce principe, ce programme offrira au vétérinaire l'opportunité de réaliser deux choses. Tout d'abord, vous suivrez un programme d'études entièrement en ligne, qui vous permettra d'acquérir les connaissances empiriques les plus récentes du paysage universitaire. Et, deuxièmement, effectuer un séjour pratique dans l'un des plus importants centres internationaux de soins aux animaux dans le but d'appliquer tout ce qui a été appris dans la modalité théorique.
En ce sens, le professionnel développera une connaissance spécialisée des différents tests de laboratoire, y compris les biopsies, l'hématologie et la cytologie. En ce sens, le professionnel développera une connaissance spécialisée des différents tests de laboratoire, y compris les biopsies, l'hématologie et la cytologie. Il est également important de considérer que, bien que le système cardiovasculaire des oiseaux soit presque similaire à celui des mammifères, les différences anatomiques sont suffisantes pour qu'il soit nécessaire de savoir lire parfaitement un électrocardiogramme. De cette manière, le professionnel pourra facilement détecter toute maladie cardiorespiratoire.
Après avoir terminé la partie théorique du cours, l'étudiant pourra effectuer un séjour de trois semaines sur place. C'est l'occasion de traiter des cas réels en appliquant toutes les connaissances et les nouveaux développements acquis précédemment. Grâce à l'expertise d'un professionnel qui vous accompagnera en permanence, vous serez en mesure de réaliser les tests de dépistage des maladies virales de base, d'administrer la dose appropriée d'anesthésie et, bien sûr, de pratiquer les interventions chirurgicales adaptées à chaque cas. Vous pourrez également utiliser tous les instruments du centre et serez soutenu par une équipe d'experts qui vous aidera à tout moment.
Pendant le mode en ligne de ce programme, vous aurez accès à différents contenus et matériels complémentaires tels que des guides pratiques, des résumés interactifs et des vidéos didactiques avec des procédures réelles chez les oiseaux"
Ce Mastère Spécialisé Hybride en Médecine et Chirurgie Aviaire contient le programme scientifique le plus complet et le plus actualisé du marché. Ses caractéristiques sont les suivantes:
- Développement de plus de 100 cas cliniques présentés par des professionnels vétérinaires axés sur le traitement des volailles
- Son contenu graphique, schématique et éminemment pratique, qui vise à fournir des informations scientifiques et d'assistance sur les disciplines médicales indispensables à la pratique professionnelle
- Évaluation et surveillance des oiseaux sauvages et captifs
- Présentation d'ateliers pratiques sur les techniques diagnostiques et thérapeutiques chez le patient Vétérinaire malade
- Un système d'apprentissage interactif basé sur des algorithmes pour faciliter la prise de décision sur les situations cliniques présentées
- Le tout sera complété par des conférences théoriques, des questions à l'expert, des forums de discussion sur des questions controversées et un travail de réflexion individuel
- Les contenus sont disponibles à partir de tout appareil fixe ou portable doté d' une connexion internet
- En outre, vous se effectuer un stage clinique dans l'un des meilleurs centres hospitaliers
Développer des connaissances spécialisées sur les pathologies oculaires les plus fréquentes et les traitements les plus récents"
Dans cette proposition de Mastère, de nature professionnalisante et de modalité d’apprentissage hybride, le programme vise à mettre à jour les professionnels vétérinaires qui exercent leurs fonctions dans le traitement médical et chirurgical des oiseaux et qui requièrent un haut niveau de qualification. Les contenus sont basés sur les dernières données scientifiques et sont orientés de manière didactique pour intégrer les connaissances théoriques. dans la pratique infirmière et les éléments théoriques-pratiques faciliteront l'actualisation des connaissances, et permettront la prise de décision dans la prise en charge des patients.
Grâce à leur contenu multimédia développé avec les dernières technologies éducatives, ils permettront au professionnel Vétérinaire d'apprendre de manière située et contextuelle, c'est-à-dire dans un environnement simulé qui fournira un apprentissage immersif programmé pour s'entraîner dans des situations réelles. La conception de ce programme est basée sur l'Apprentissage par les Problèmes, grâce auquel le médecin devra essayer de résoudre les différentes situations de pratique professionnelle qui se présentent tout au long du programme. Pour ce faire, il sera assisté d'un système vidéo interactif innovant créé par des experts reconnus.
En vous exerçant dans un environnement contrôlé, vous pourrez acquérir l'expérience nécessaire à une future pratique de qualité”

Faites avancer votre carrière en pratiquant des interventions chirurgicales sur le système digestif et respiratoire de tout oiseau, grâce à ce programme pratique”
Programme d'études
Le contenu de ce programme est conçu pour répondre aux besoins des vétérinaires qui souhaitent poursuivre leur carrière en se spécialisant dans la médecine des volailles. En ce sens, TECH fournit au spécialiste un programme qui couvre des questions telles que la procédure étape par étape pour effectuer un examen médical complet d'un oiseau, le préparer pour une procédure chirurgicale ou effectuer une étude cardiaque pour identifier les maladies coronariennes. Dès le module 1, l'étudiant verra ses connaissances élargies et soutenues par une équipe d'enseignants experts et de haut niveau.

Les contenus sont disponibles à partir de tout appareil doté d'une connexion internet. Une opportunité unique pour étudier à votre Rythme"
Module 1. Taxonomie, anatomie et physiologie des Oiseaux
1.1. Classification taxinomique de Psitaciformes
1.1.1. Classification taxonomique
1.1.2. Distribution mondiale
1.1.3. Différences anatomiques
1.2. Classification taxonomique des oiseaux sauvages
1.2.1. Classification taxonomique
1.2.2. Distribution mondiale
1.2.3. Différences anatomiques
1.3. Classification taxonomique des Falconiformes et autres ordres
1.3.1. Classification taxonomique
1.3.2. Distribution mondiale
1.3.3. Différences anatomiques
1.4. Système squelettique
1.4.1. L'ossification des os
1.4.2. Le crâne
1.4.2.1. La zone prémaxillaire
1.4.2.2. La mandibule
1.4.3. Le squelette axillaire. Les muscles épiaxiaux et hypoaxiaux
1.4.3.1. Vertèbres cervicales
1.4.3.2. Vertèbres thoraciques
1.4.3.3. Le synsacrum: anatomie spéciale
1.4.3.4. Vertèbres caudales
1.4.3.5. Sternum
1.4.3.6. L'aile. Anatomie complète et muscles pour le vol
1.4.4. Les membres pelviens
1.4.4.1. Le fémur et le tibiotarse
1.4.4.2. Les phalanges. Placement des doigts chez différentes espèces
1.5. Le système circulatoire
1.5.1. Anatomie artérielle
1.5.2. Retour veineux
1.5.3. Le système porte rénal
1.5.4. La composition du sang: les globules rouges nucléés
1.6. Le système respiratoire
1.6.1. La cavité nasale
1.6.2. Le larynx et la trachée
1.6.3. La syrinx. L'organe vocal des oiseaux
1.6.4. Les poumons
1.6.4.1. Échange de gaz
1.6.5. Les sacs d'air
1.7. Le système digestif
1.7.1. Le bec. Substitut des lèvres et des dents chez les mammifères
1.7.1.1. Emplacement de la cire
1.7.1.2. Fonctions du bec
1.7.2. L'oropharynx
1.7.2.1. Prise d'aliments solides
1.7.2.2. Aliments liquides
1.7.3. L'œsophage
1.7.4. L’estomac
1.7.4.1. Proventricule
1.7.4.2. Ventricule
1.7.5. Le foie
1.7.6. Le pancréas
1.7.7. Le faisceau intestinal
1.8. Le système urinaire et reproductif
1.8.1. Les reins
1.8.2. Les uretères
1.8.3. Particularités de l'appareil urinaire. La glande saline
1.8.4. Sexage des oiseaux
1.8.5. Système reproductif masculin
1.8.6. Système reproductif féminin
1.9. Le système nerveux
1.9.1. Organes des sens
1.9.2. La vue. Anatomie de l'œil aviaire
1.9.3. Audience
1.9.4. Odeur et goût
1.9.5. Toucher Le tégument
1.10. Particularités de l'anatomie et de la physiologie aviaires
1.10.1. Thymus
1.10.2. La bourse de Fabricius
1.10.3. La rate
1.10.4. La glande pituitaire. La glande pituitaire
1.10.5. Glande thyroïde et parathyroïde
1.10.6. Autres particularités
Module 2. Critères cliniques du patient aviaire
2.1. Entretien de l'oiseau
2.1.1. Meubles spéciaux. Types de cages
2.1.2. Stress
2.1.3. Exercice physique
2.1.4. Maintien en captivité des oiseaux
2.1.5. Lumière ultraviolette
2.1.6. Colorants de la plume
2.1.7. Disposition de l’eau
2.1.8. Médicaments ajoutés dans l’eau
2.1.9. Bains et pulvérisations avec de eau
2.2. Capture: examen physique approprié
2.2.1. Capture par des moyens physiques
2.2.1.1. Techniques de piégeage
2.2.1.2. Blessures associées
2.2.2. Piégeage chimique
2.2.2.1. Techniques de piégeage
2.2.2.2. Médicaments utilisés
2.2.3. Le confinement de l'oiseau
2.3. Gestion clinique et médecine préventive
2.3.1. L'examen physique complet et ordonné
2.3.2. Vaccination
2.3.3. Déparasitage
2.3.4. Stérilisation
2.4. Prélèvement et administration de médicaments
2.4.1. Voie intraveineuse
2.4.2. Voie intra-osseuse:
2.4.3. Posologie orale
2.4.4. Voie intramusculaire
2.4.5. Voie sous-cutanée
2.4.6. Voie topique
2.4.7. Autres voies d'entrée chez le patient aviaire
2.5. La volaille comme patient
2.5.1. Les défis de l'élevage d'un poulet de compagnie
2.5.2. Les poulets comme patients
2.5.3. Les races les plus courantes de poulets et de poules
2.6. Besoins nutritionnels Alimentation
2.6.1. Modes d'alimentation
2.6.2. Composition nutritionnelle des aliments pour animaux
2.6.2.1. Glucides
2.6.2.2. Protéines
2.6.2.3. Graisses
2.6.2.4. Vitamines
2.6.2.4.1. Vitamines liposolubles
2.6.2.4.2. Vitamines hydrosolubles
2.6.2.4.3. Les antivitamines
2.6.2.5. Minéraux
2.7. Type d'alimentation des psittacidés
2.7.1. Mélange de semences
2.7.2. Alimentation
2.7.2.1. Différences entre les granulés et les extrudés
2.7.3. Fruits et légumes
2.7.4. Graines germées
2.7.5. Légumes secs cuits
2.7.6. Pâtes à rôtir
2.7.6.1. Effets souhaitables et indésirables
2.7.7. Autres produits
2.7.8. Calcul des besoins en énergie
2.7.8.1. Basal Metabolic Rate (BMR)
2.7.8.2. Maintenance Energy Requirements (MER)
2.8. Régime alimentaire généralisé pour les psittacidés les plus couramment rencontrés en clinique
2.8.1. Perruche d'Australie (Melopsittacus undulattus)
2.8.2. Nymphicus hollandicus (Nymphicus hollandicus)
2.8.3. Inséparables (Agapornis spp.)
2.8.4. Perroquet gris africain (Psithacus erithacus)
2.9. Régime alimentaire généralisé pour les psittacines moins fréquemment rencontrées en clinique
2.9.1. Amazones (Amazona sp)
2.9.2. Ara (Ara sp)
2.9.3. Cacatoès (Cacatua sp)
2.9.4. Ecleptus (Ecleptus roratus)
2.9.5. Loris
2.9.6. Conversion des aliments pour psittacines
2.10. Autres aspects de l'alimentation
2.10.1. L'alimentation chez les passereaux
2.10.2. Alimentation d'autres oiseaux
2.10.3. L'alimentation des patients hospitalisés
Module 3. Tests de laboratoire
3.1. Principes généraux des techniques cliniques et de diagnostic. Preuves diagnostiques
3.1.1. Obtenir un diagnostic précis
3.1.2. Considérations sur la préparation des échantillons
3.1.3. Transport et traitement des échantillons
3.2. L'hématologie: un outil indispensable
3.2.1. Morphologie cellulaire
3.2.1.1. La série rouge du sang
3.2.1.2. La série blanche du sang
3.2.2. Modifications morphologiques des cellules sanguines
3.2.2.1. Dégranulation
3.2.2.2. Immaturité
3.2.2.3. Toxicité
3.2.2.4. Réactivité
3.2.3. Facteurs à prendre en compte en hématologie
3.2.4. Protocoles d'hématologie chez les volailles
3.2.4.1. Numération des érythrocytes
3.2.4.2. Estimation de l'hémoglobine
3.2.4.3. Estimation de l'hématocrite
3.2.4.4. Numération des leucocytes
3.2.4.5. Numération des thrombocytes
3.2.4.6. Estimation du fibrinogène
3.3. Analyse biochimique de l'oiseau
3.3.1. Plages de référence biochimiques
3.3.2. Profils les plus couramment utilisés
3.3.2.1. Protéines totales: augmentation et diminution
3.3.2.2. Glucose: augmentation et diminution
3.3.2.3. Acide urique, urée, créatinine
3.3.2.4. Lactate déshydrogénase (LDH)
3.3.2.5. Transaminase glutamique-oxaloacétique sérique (SGOT)
3.3.2.6. Acides biliaires
3.3.2.7. Créatine phosphokinase (CPK). Insuffisance musculaire ou cardiaque
3.3.2.8. Calcium: hypercalcémie et hypocalcémie
3.3.2.9. Phosphore
3.3.2.10. Cholestérol
3.3.3. Modifications biochimiques liées à l'âge
3.3.3.1. Le protéinogramme comme outil de diagnostic
3.3.3.2. Albumine
3.3.3.3. Alpha-1: indicateur d'une phase aiguë de la maladie
3.3.3.4. Alpha-2: protéines de la phase aiguë d'une maladie
3.3.3.5. La fraction bêta
3.3.3.6. La fraction gamma
3.4. L'analyse d'urine. Suspicion de néphropathie
3.4.1. Rappel anatomo-physiologique de l'appareil urinaire
3.4.2. Techniques de collecte d'urine chez la volaille
3.4.3. Analyse d'urine
3.4.4. Paramètres d'analyse de l'urine
3.5. Techniques cytologiques fondamentales. L'étude des cellules
3.5.1. Raclures de peau et de plumage
3.5.1.1. Comment effectuer un grattage superficiel
3.5.1.2. Comment effectuer un grattage en profondeur
3.5.2. Collecte des biopsies
3.5.2.1. Différentes techniques pour son application
3.5.2.2. Biopsies cutanées
3.5.2.3. Biopsies de lésions squelettiques
3.5.2.4. Biopsies de petits organes et de masses
3.5.2.5. Biopsies de lésions chroniques
3.5.2.6. Biopsies de petites lésions et de masses
3.5.3. Cytologie: fonctions
3.5.3.1. Collecte et traitement des échantillons
3.5.3.2. Points clés et interprétations cytologiques
3.6. Techniques cytologiques avancées
3.6.1. Effectuer une aspiration
3.6.1.1. Tests complémentaires
3.6.1.2. Méthodes d'aspiration
3.6.2. Collecte d'écouvillons microbiologiques
3.6.2.1. Voies respiratoires supérieures
3.6.2.2. Tractus gastro-intestinal inférieur
3.6.3. La technique de lavage
3.6.3.1. Rinçage de la culture
3.6.3.2. Lavage des sacs d'air
3.7. Préparations pour la réalisation d'une nécropsie
3.7.1. Aspects fondamentaux
3.7.1.1. Examen post-mortem
3.7.1.2. L'importance de l'anamnèse et des antécédents médicaux du patient
3.7.2. Équipement nécessaire Instruments
3.7.3. Sélection des tissus dans les cas de nécropsie
3.7.4. Préservation des spécimens pour des études diagnostiques ultérieures
3.7.5. Le registre. Lésions et résultats
3.8. Évaluation externe du patient lors de l'examen post-mortem
3.8.1. Peau et appendices. Preuve de traumatisme
3.8.2. Le système squelettique
3.8.3. Le système sensoriel
3.8.4. Système musculaire. L'examen initial
3.9. Évaluation interne du patient lors de l'examen post-mortem
3.9.1. Le système cardiorespiratoire et cardiovasculaire
3.9.2. Le système lymphoréticulaire
3.9.3. Le foie
3.9.4. Le système digestif
3.9.5. Évaluation du système urinaire
3.9.6. Analyse de l'appareil reproducteur
3.9.6.1. Nécropsie chez les femelles
3.9.6.2. Nécropsie chez les mâles
3.9.7. Évaluation nécrologique du système nerveux
3.9.8. Conclusion de l'examen effectué
3.10. Procédures de diagnostic dans la technique de nécropsie
3.10.1. Examen histopathologique des spécimens collectés
3.10.1.1. Collecte d'échantillons
3.10.2. Analyse microbiologique
3.10.2.1. La technique de l'écouvillon
3.10.3. Réaction en chaîne par polymérase (PCR)
3.10.3.1. Laryngotrachéite infectieuse
3.10.3.2. Bronchite infectieuse
3.10.3.3. Poxvirus
3.10.3.4. Mycoplasma gallisepticum, Mycoplasma synoviae
3.10.3.5. Autres maladies
Module 4. Techniques d'imagerie diagnostique
4.1. Quand anesthésier un oiseau pour une technique de diagnostic?
4.1.1. Anesthésie volatile
4.1.2. Anesthésie injectable
4.1.3. Anesthésie dans des conditions particulières
4.2. Équipement requis pour la radiologie
4.2.1. Considérations générales
4.2.2. L'unité de radiographie
4.2.3. Écrans, châssis et films
4.3. Le patient: contention et positionnement
4.3.1. Projection latéro-latérale
4.3.2. Projection ventrodorsale
4.3.3. Projection craniocaudale
4.3.4. Projection de l'aile
4.3.5. Projection caudo-plantaire
4.4. Types de radiographies. L'étude radiographique par contraste
4.4.1. Radiographie conventionnelle
4.4.2. Études de contraste gastro-intestinales
4.4.3. Études de contraste respiratoire
4.4.4. Urographie
4.4.5. Myélographie
4.5. Interprétations radiologiques
4.5.1. Anatomie appliquée à la radiographie
4.5.2. Résultats radiographiques anormaux du système respiratoire
4.5.3. Résultats radiographiques anormaux du système digestif
4.5.4. Résultats radiographiques anormaux du système squelettique
4.6. Aspects fondamentaux de l'échographie aviaire
4.6.1. Le diagnostic complet par ultrasons
4.6.1.1. Sondes linéaires convexes, microconvexes et phased array
4.6.1.2. Ultrasonographie
4.6.2. Cibles diagnostiques spécifiques chez les volailles et leurs limites
4.6.3. Matériel technique nécessaire à l'échographie
4.7. Approches avancées de l'échographie chez les oiseaux
4.7.1. Préparation du patient à l'échographie
4.7.2. Rappel anatomique appliqué et positionnement correct du patient
4.7.3. Interprétation des ultrasons
4.8. Endoscopie
4.8.1. Endoscopie
4.8.1.1. Équipement requis pour l'endoscopie
4.8.1.2. L'endoscope rigide
4.8.2. Préparation et positionnement du patient pour l'endoscopie
4.8.3. Applications cliniques et chirurgicales de l'endoscopie aviaire
4.9. La cardiologie aviaire. Fondamentaux et bases
4.9.1. Anatomie du système cardiaque aviaire
4.9.2. Examen clinique des oiseaux
4.9.3. Électrocardiographie aviaire
4.10. Tests cliniques vétérinaires chez les volailles
4.10.1. Sérotypage de maladies importantes
4.10.1.1. Salmonella spp
4.10.2. Tests coprologiques
4.10.2.1. Parasitologie
4.10.2.2. Bactériologie
4.10.3. Sérologie des maladies les plus importantes en médecine avicole
4.10.3.1. Laryngotrachéite infectieuse
4.10.3.2. Bronchite infectieuse
4.10.3.3. Maladie de Newcastle
4.10.3.4. Mycoplasma spp
4.10.3.5. La grippe aviaire
Module 5. Pathologies liées à la gestion
5.1. Pathologies les plus courantes
5.1.1. Parésie par capture. Cause de mortalité chez les oiseaux
5.1.1.1. Espèces touchées et symptomatologie caractéristique
5.1.1.2. Physiopathologie
5.1.1.3. Diagnostic différentiel
5.1.1.4. Traitement et prévention
5.1.2. Le saturnisme
5.1.2.1. Diagnostic
5.1.2.2. Traitement
5.2. Autre empoisonnement
5.2.1. Empoisonnement au zinc
5.2.2. Diagnostic
5.2.2.1. Traitement
5.2.2.2. Traitement primaire
5.2.2.3. Traitement par chélation
5.2.2.4. Traitement de soutien
5.2.3. Intoxication au chlorure d'ammonium chez les falconiformes
5.2.3.1. Signes cliniques
5.2.3.2. Changements pathologiques
5.2.3.3. Considérations physiologiques et pathologiques
5.2.4. Intoxication au cuivre
5.2.4.1. Diagnostic
5.2.4.2. Traitement
5.2.4.2.1. Traitement par chélation
5.2.4.2.2. Traitement de soutien
5.3. Pathologies résultant d'une alimentation incorrecte
5.3.1. Ostéopathies métaboliques: lésions osseuses
5.3.2. Causes et types de lésions les plus courants
5.3.3. Symptomatologie et espèces sensibles
5.3.4. Diagnostics et traitements actuels
5.3.5. Déformations des os longs: torsion et flexion
5.3.5.1. Description du type de pathologie
5.3.5.2. Signes cliniques chez l'oiseau
5.3.5.3. Traitement et prévention
5.3.6. Altérations osseuses des os les plus distaux: déformation
5.3.6.1. Tendon glissé
5.3.6.2. Aile d'ange
5.3.6.3. Orteils roulés
5.3.7. Cachexie due à la famine
5.3.7.1. Définition et étiologie Symptomatologie
5.3.7.2. Résultats de l'autopsie
5.3.7.3. Traitement et prévention
5.3.8. Ostéodystrophie comportementale
5.4. Troubles de la cavité buccale
5.4.1. Pathologies localisées dans le bec
5.4.2. La cavité orale et l'oropharynx. La langue et les glandes salivaires
5.4.2.1. l'hypovitaminose A
5.4.2.2. Traumatismes
5.4.2.3. Hémorragie
5.4.2.4. Néoplasie
5.4.2.5. Halitose
5.4.3. Maladies infectieuses des oiseaux
5.4.3.1. Nécrose de la muqueuse
5.4.3.2. La variole aviaire
5.4.3.3. Anatidae herpesvirus (entérite virale des canards ou peste des canards)
5.4.3.4. Candidiasis (infection à Candida albicans)
5.5. Pathologies de l'œsophage et du jabot
5.5.1. Oesophagite, ingluvite. Impaction œsophagienne et/ou ingluviale
5.5.2. Infestation de l'œsophage et/ou du jabot par Capillaria contorta et d'autres Capillaria spp
5.5.3. Candidose et trichomonase
5.5.3.1. Oesophagien et ingluvial
5.5.4. Pathologies ingluviales
5.5.4.1. Stase et calculs
5.5.5. Pathologies de la culture
5.5.5.1. "Syndrome du gosier aigre"
5.5.5.2. Syndrome de la culture acide
5.5.5.3. Régurgitation du contenu des cultures
5.5.6. Tumeurs courantes
5.6. Pathologies du proventricule
5.6.1. La maladie de la dilatation proventriculaire chez les oiseaux Psittaciformes
5.6.2. Impaction du proventricule et du gésier
5.6.3. Candidiasis (infection à Candida albicans)
5.6.4. Autres pathologies
5.6.4.1. Atonia
5.6.4.2. Hypertrophie d'étiologie inconnue
5.6.4.3. Proventriculite
5.6.4.4. Présence de corps étrangers
5.7. Pathologies du gésier ou du ventricule. L'estomac glandulaire
5.7.1. Maladie de la dilatation proventriculaire
5.7.2. Ulcérations du gésier
5.7.3. Infestation par des nématodes de l'estomac
5.7.4. Tumeurs Malignes
5.7.5. Autres pathologies
5.7.5.1. Atrophie musculaire et ventriculite traumatique
5.8. Pathologies de l'intestin de la volaille
5.8.1. Syndrome de malabsorption
5.8.2. Entéropathies non spécifiques
5.8.2.1. Diarrhée chez les oiseaux
5.8.3. Troubles de l'intestin postérieur
5.8.3.1. Impaction rectale colorée
5.8.3.2. Prolapsus rectal
5.8.3.2.1. Surcharge intestinale
5.8.4. Tumeurs les plus courantes
5.8.5. Le cloaque
5.8.5.1. Chloacitis: "écoulement gonorrhée"
5.8.5.2. Prolapsus
5.8.5.3. Tumeurs les plus courantes
5.9. Pathologies du foie
5.9.1. Lipidose
5.9.1.1. Infiltration graisseuse ou dégénérescence graisseuse
5.9.2. Hémochromatose
5.9.2.1. Le stockage du fer dans l'organisme aviaire
5.9.3. Goutte viscérale
5.9.4. Amyloïdose
5.9.5. Tumeurs les plus courantes
5.9.6. Autres pathologies
5.9.6.1. Hépatite toxique et diabète sucré
5.10. Troubles endocriniens
5.10.1. Glandes thyroïdiennes
5.10.2. Glandes parathyroïdes
5.10.3. Les glandes surrénales
5.10.4. Les glandes ultimobranchiales
5.10.4.1. Localisation thoracique
5.10.5. Hypophyse. Le cerveau aviaire
5.10.6. Pancréas Fonction endocrine et exocrine
5.10.6.1. Pancréatite
5.10.6.2. Nécrose pancréatique aiguë
5.10.6.3. Tumeurs les plus courantes
Module 6. Maladies du patient aviaire
6.1. Maladies virales
6.1.1. Maladies virales
6.1.2. Maladie de Newcastle (Famille Paramyxoviridae)
6.1.2.1. Étiologie
6.1.2.2. Classification des sérotypes
6.1.2.3. Caractéristiques cliniques et pathophysiologie
6.1.2.4. Techniques de diagnostic et traitement
6.1.3. Variole aviaire (virus de la famille des Poxviridae)
6.1.3.1. Sérotypes détectés chez les oiseaux
6.1.3.2. Signes cliniques chez le patient
6.1.3.3. Diagnostic et traitement
6.2. Autres infections virales cliniquement pertinentes
6.2.1. Virus de l'influenza chez les oiseaux (Famille Orthomyxoviridae)
6.2.1.1. Épizootiologie de la maladie
6.2.1.2. Signes cliniques chez l'oiseau
6.2.1.3. Diagnostic
6.2.1.4. Prévention et contrôle
6.2.2. Infections à herpèsvirus
6.2.2.1. Étiologie
6.2.2.2. La maladie de Marek
6.2.2.2.1. Paralysie polynévrite
6.2.2.3. La peste des canards
6.2.2.3.1. Entérite virale du canard
6.2.2.4. Laryngotrachéite infectieuse aviaire
6.2.2.5. Herpès
6.2.3. Autres maladies virales
6.3. Les maladies bactériennes les plus courantes en clinique
6.3.1. Pasteurellose: choléra
6.3.1.1. Histoire: agent étiologique et transmission de la maladie
6.3.1.2. Espèces sensibles et symptômes
6.3.1.3. Diagnostic
6.3.1.4. Traitement et immunité
6.3.2. Chlamydiose: ornithose-psittacose
6.3.2.1. Causes et espèces les plus sensibles
6.3.2.2. Diagnostic efficace
6.3.2.3. Traitement et prévention
6.3.3. Salmonellose
6.3.3.1. Définition
6.3.3.2. Agent étiologique
6.3.3.3. Distribution
6.3.3.4. Espèces sensibles
6.3.3.5. Transmission
6.3.3.6. Diagnostic
6.3.3.7. Traitement/prévention
6.4. Maladies bactériennes moins courantes dans la clinique
6.4.1. La tuberculose aviaire: Mycobacterium spp
6.4.1.1. Causes et espèces les plus sensibles
6.4.1.2. Diagnostic efficace
6.4.1.3. Traitement et prévention
6.4.2. Pseudotuberculose (yersiniose)
6.4.2.1. Causes et espèces les plus sensibles
6.4.2.2. Diagnostic efficace
6.4.2.3. Traitement et prévention
6.4.3. Infections à Escherichia coli
6.4.3.1. Définition
6.4.3.2. Agent étiologique
6.4.3.3. Distribution
6.4.3.4. Espèces sensibles
6.4.3.5. Transmission
6.4.3.6. Diagnostic
6.4.3.7. Traitement/prévention
6.5. Autres maladies bactériennes chez le patient aviaire
6.5.1. Botulisme
6.5.1.1. Histoire et distribution
6.5.1.2. Transmission
6.5.1.2.1. Bacilles de Clostridium botulinum
6.5.1.3. Symptômes et lésions cliniques
6.5.1.4. Diagnostic et traitement de la maladie
6.5.2. Maladie rouge: Erysipelothrix rhusiopathiae
6.5.2.1. Étiologie et transmission de l'agent causal: oiseaux sauvages
6.5.2.2. Détection efficace
6.5.2.2.1. Symptômes et lésions
6.5.2.3. Diagnostic et traitement
6.5.3. Listériose: listeria monocytogenes
6.5.3.1. Histoire: agent étiologique et transmission de la maladie
6.5.3.2. Symptômes détectés chez les oiseaux
6.5.3.3. Diagnostic et traitement efficace
6.6. Maladies fongiques
6.6.1. Aspergillose
6.6.1.1. Caractéristiques pertinentes de la maladie
6.6.1.2. Signes cliniques détectés chez le patient
6.6.1.3. Techniques de diagnostic efficaces
6.6.1.4. Traitement, prévention et prophylaxie
6.6.2. Candidiasis
6.6.2.1. Signes cliniques chez le patient aviaire atteint de Candida albicans
6.6.2.2. Techniques de diagnostic en laboratoire
6.6.2.3. Traitement et contrôle de la pathologie
6.6.3. Dermatophytose. Tinea
6.6.3.1. Facteurs prédisposants et types d'oiseaux affectés
6.6.3.2. Signes cliniques courants
6.6.3.3. Diagnostic et suivi
6.7. Ectoparasites
6.7.1. Diptères (Diptera)
6.7.1.1. Mouches et moucherons
6.7.2. Puces (Siphonaptères)
6.7.3. Poux (Phthiraptera - Mallophaga)
6.7.4. Punaises de lit (Hemiptera - Cimicidae)
6.7.4.1. Ectoparasites hématophages
6.7.5. Acariens (Acari)
6.7.5.1. Les ectoparasites les plus courants
6.7.6. Tiques (Ixodida)
6.7.6.1. Parasites grossiers
6.7.7. Coléoptères (Coleoptera)
6.7.7.1. Vecteurs de maladies
6.8. Performances de l'analyse coprologique chez les oiseaux
6.8.1. Les techniques coprologiques les plus importantes
6.8.2. Trématodes
6.8.2.1. Staves
6.8.3. Cestodes
6.8.3.1. Tapeworms
6.8.4. Nématodes
6.8.4.1. Localisations particulières des nématodes et de leurs pathologies
6.9. Protozoaires: Micro-organismes constitués d'une seule cellule
6.9.1. Coccidiose chez les Anseriformes, Galliformes et Passeriformes
6.9.1.1. Espèces Eimeria et Isospora
6.9.1.2. Espèces de Caryospora
6.9.1.3. Autres espèces de coccidies chez les oiseaux
6.9.2. La trichomonase: Trichomonas spp
6.9.3. Autres protozoaires
6.9.3.1. Giardia, Hexamita et Histomonas spp
6.10. Hémoparasites
6.10.1. Les microfilaires
6.10.1. Espèces de Plasmodium
6.10.3. EspècesHaemoproteus
6.10.4. Espèces de Leucocytozoon
6.10.5. Trypanosomiase
6.10.6. Espèce Hepatozoon
6.10.7. Espèces de Babesia
6.10.7.1. Piroplasmes aviaires
6.10.8. Autres espèces en cours de discussion
Module 7. Anesthésie et analgésie chez les volailles
7.1. Caractéristiques anatomiques et physiologiques pour l'anesthésie aviaire
7.1.1. Caractéristiques anatomiques Les sacs d'air
7.1.2. Considérations physiologiques
7.1.2.1. Inspiration et expiration
7.1.2.2. Déclencheurs ventilatoires
7.1.2.3. Hypoglycémie
7.1.3. Caractéristiques pharmacocinétiques et pharmacodynamiques du patient aviaire
7.2. Administration à distance de l'anesthésie
7.2.1. Sécurité des manipulateurs
7.2.2. Des oiseaux coopératifs. Manipulation appropriée
7.2.2.1. Voies et techniques d'administration de l'anesthésie
7.2.3. Des oiseaux peu coopératifs. Oiseaux sauvages
7.2.3.1. Techniques d'administration de l'anesthésie
7.2.3.2. Darting
7.2.3.3. Autres mécanismes
7.2.4. Stress avant l'administration de l'anesthésie
7.2.4.1. Activation du système nerveux sympathique
7.2.4.2. Autres changements hormonaux
7.2.4.3. Comment mesurer le stress
7.2.4.4. Effets physiologiques du piégeage
7.3. Anesthésie par inhalation chez les volailles. L'anesthésie de choix
7.3.1. Considérations techniques relatives aux équipements d'anesthésie
7.3.1.1. Gaz et vapeurs
7.3.1.1.1. Isofluorane, sevofluorane et autres gaz anesthésiques
7.3.2. Intubation endotrachéale
7.3.3. Intubation endotrachéale
7.3.3.1. Intubation du sac d'air
7.4. Une intubation exceptionnelle
7.4.1. Réflexes
7.4.2. Surveillance pendant l'anesthésie
7.4.3. Douleur
7.4.4. Surveillance cardiovasculaire
7.4.4.1. L'auscultation cardiaque
7.4.4.2. Temps de remplissage capillaire
7.4.4.3. Électrocardiogramme
7.4.4.4. Surveillance cardiaque par Doppler ou échocardiographie
7.4.4.5. Autres techniques de surveillance
7.4.4.6. La fluidothérapie intraveineuse
7.4.4.6.1. Cristalloïdes et colloïdes
7.4.5. Surveillance de la respiration
7.4.5.1. Auscultation respiratoire
7.4.5.2. Oxymètre de pouls
7.4.5.3. Le capnographe
7.4.6. Surveillance de la température: hypothermie et hyperthermie
7.4.6.1. Perte de la température corporelle pendant l'opération. Suivi et prévention
7.4.6.2. Conséquences de l'hypothermie
7.4.6.3. Hyperthermie
7.4.6.3.1. Prévention et traitement
7.5. Anesthésie injectable
7.5.1. La perfection anesthésique
7.5.2. Anesthésiques dissociatifs
7.5.3. Opioïdes
7.5.4. Anesthésie dans des conditions de terrain
7.5.5. Hypothermie
7.5.5.1. Aspects importants pour prévenir/réduire la perte de chaleur pendant l'anesthésie des volailles
7.6. Anesthésie et analgésie locales
7.6.1. Anesthésie locale
7.6.1.1. Surveillance cardiovasculaire
7.6.1.2. Médicaments utilisés
7.6.1.3. Options thérapeutiques
7.6.2. Analgésie
7.6.2.1. Types de douleur: analgésie
7.6.2.2. La sensibilité physiologique chez les oiseaux
7.6.2.3. Médicaments analgésiques
7.6.2.3.1. Acide acétylsalicylique
7.6.2.3.2. Chlorhydrate de buprénorphine
7.6.2.3.3. Butorphanol
7.6.2.3.4. Flunixine-meglumine
7.6.2.3.5. Carprofène
7.6.2.3.6. Kétoprofène
7.6.2.3.7. Cuivre indométhacine
7.6.2.3.8. Meloxicam
7.6.2.3.9. Autres analgésiques
7.7. Urgences anesthésiques
7.7.1. Complications respiratoires pendant l'anesthésie
7.7.1.1. Dépression respiratoire
7.7.1.2. Apnée et arrêt respiratoire
7.7.1.3. Obstruction des voies respiratoires
7.7.1.4. Hyperventilation
7.7.1.5. Hypoxie
7.7.2. Complications cardiovasculaires spécifiques pendant l'anesthésie
7.7.2.1. Bradycardie
7.7.2.2. Tachycardie
7.7.2.3. Hypotension
7.7.2.4. Hypertension artérielle
7.7.2.5. Arythmies
7.7.2.6. Arrêt cardiaque
7.7.3. Hémorragie chez le patient aviaire pendant l'anesthésie
7.8. de l'anesthésie aux oiseaux en cage: psittaciformes et passereaux
7.8.1. Considérations anatomiques et physiologiques
7.8.2. Le système cardiovasculaire
7.8.3. Thermorégulation
7.8.4. Systèmes de ventilation respiratoire
7.8.5. Évaluation pré-anesthésique de l'oiseau
7.8.6. La procédure d'anesthésie
7.8.7. Types d'anesthésiques utilisés
7.8.8. Anesthésie et analgésie locales
7.9. Anesthésie chez les oiseaux aquatiques et semi-aquatiques
7.9.1. Le patient: oiseaux aquatiques et semi-aquatiques
7.9.2. Surveillance des constantes physiologiques
7.9.3. Thermorégulation
7.9.4. La procédure d'anesthésie
7.9.5. Types d'anesthésiques utilisés
7.9.6. Anesthésie et analgésie locales
7.10. Autres particularités de l'anesthésie
7.10.1. Particularités de l'anesthésie chez les ratites
7.10.1.1. Considérations anatomiques et physiologiques
7.10.1.2. Procédure d'anesthésie
7.10.1.3. Types d'anesthésiques
7.10.1.4. Anesthésie et analgésie locales
7.10.2. Anesthésie chez les galliformes
7.10.3. Anesthésie chez les falconiformes
7.10.4. L'euthanasie: un acte humain
7.10.4.1. Considérations particulières
Module 8. Anesthésie et chirurgie des tissus mous
8.1. Chirurgie des tissus mous
8.1.1. Le chirurgien des tissus mous aviaires
8.1.2. Préparation du patient
8.1.2.1. Hypothermie
8.1.2.2. Préparation de la peau
8.1.3. Équipement nécessaire
8.1.4. Ouates stériles
8.1.5. Lentilles chirurgicales bifocales
8.1.6. Instruments microchirurgicaux
8.1.7. Matériaux de suture
8.2. Matériel chirurgical spécial pour la chirurgie des volailles
8.2.1. Hémoclips
8.2.2. Radiochirurgie
8.2.3. Lasers chirurgicaux
8.2.3.1. Types et équipements les plus couramment utilisés
8.2.4. Microchirurgie
8.3. Chirurgie cutanée et annexielle
8.3.1. Kystes de plumes
8.3.1.1. Plumafolliculoma
8.3.2. Glande uropygote
8.3.2.1. Les pathologies les plus courantes
8.3.3. Traitement des plaies et des blessures des tissus mous
8.3.4. Tumeurs les plus courantes
8.3.4.1. Lipome
8.3.4.2. Xanthome
8.4. Techniques de l'appareil reproducteur
8.4.1. Préparation préalable du patient
8.4.2. Stérilisation
8.4.3. Salpingo-hystérectomie Salpingo-hystérectomie: stérilisation de la chienne
8.4.3.1. Technique chirurgicale
8.4.4. Obstruction des œufs dans l'oviducte. Dystocie chez l'oiseau
8.4.4.1. Césarienne. Obstruction des œufs dans l'oviducte
8.4.4.2. Torsion utérine. Inflammation du coelome
8.4.5. Orchidectomie
8.4.5.1. Localisation anatomique du testicule. Intracellulaire
8.4.5.2. Technique
8.4.6. Biopsie testiculaire endoscopique
8.5. Techniques pour le tractus gastro-intestinal I
8.5.1. La langue
8.5.1.1. les pathologies les plus courantes
8.5.2. L'œsophage proximal
8.5.2.1. Les sténoses œsophagiennes. Causes et traitements
8.5.2.2. Traumatisme oesophagien. Causes et traitements
8.5.3. Ingluviotomie
8.5.3.1. Localisation
8.5.3.2. Indications. Corps étrangers
8.5.4. Brûlures de la récolte
8.5.4.1. Origine de la pathologie
8.5.4.2. Technique chirurgicale appropriée
8.5.5. Autres techniques chirurgicales de choix
8.6. Techniques du tractus gastro-intestinal II
8.6.1. Lacérations du jabot ou de l'œsophage
8.6.1.1. Alimentation traumatique. Causes et traitements
8.6.1.2. Traumatisme externe. Causes et traitements
8.6.2. Mise en place d'un tube d'ingluviostomie
8.6.2.1. Indications pour une sonde d'alimentation
8.6.3. Coeliotomie. Ouverture de la cavité coelomique
8.6.3.1. Indications et complications
8.6.3.2. Céliotomie latérale gauche
8.6.4. Autres techniques chirurgicales de choix
8.7. Techniques du tractus gastro-intestinal III
8.7.1. Proventriculotomie: accès au proventricule ou au ventricule
8.7.1.1. Indications
8.7.1.2. Technique chirurgicale de choix
8.7.2. Saculectomie du vitellus. Poussins nouveau-nés
8.7.2.1. Indications
8.7.2.2. Technique chirurgicale de choix
8.7.3. Enterotomie
8.7.3.1. Cas dans lesquels une entérotomie est nécessaire
8.7.3.2. Type de chirurgie à effectuer
8.7.4. Enterectomie. Anastomose intestinale
8.7.4.1. Situations cliniques
8.7.4.2. Procédure chirurgicale
8.7.5. Céliotomie de la ligne médiane ventrale
8.7.5.1. Indications pour cet accès chirurgical
8.7.5.2. Les approches
8.7.6. Troubles cloacaux
8.7.6.1. Prolapsus d'organes par le cloaque
8.7.6.2. Cloacolithe
8.8. Procédures de biopsie
8.8.1. Biopsie hépatique
8.8.1.1. Indications pour cet accès chirurgical
8.8.1.2. L'approche
8.8.2. Biopsie pancréatique
8.8.2.1. Altérations pancréatiques
8.8.2.2. Indications chirurgicales
8.8.3. Biopsie rénale
8.8.3.1. Indications
8.8.3.2. Moyens techniques requis
8.8.3.3. Technique et approche
8.9. Techniques de chirurgie respiratoire
8.9.1. Chirurgie respiratoire
8.9.1.1. Rappel anatomique nécessaire
8.9.2. Trachéostomie
8.9.2.1. Indications
8.9.2.1.1. Présence d'aspergillomes et de corps étrangers
8.9.2.2. Technique chirurgicale
8.9.3. Trachéostomie
8.9.3.1. Indications. Sténose trachéale
8.9.3.2. Technique chirurgicale
8.9.4. Biopsie pulmonaire
8.9.4.1. Indications. Sténose trachéale
8.9.4.2. Technique chirurgicale
8.9.5. Le silence des oiseaux
8.9.5.1. Considérations éthiques
8.10. Soins postopératoires
8.10.1. Situations stressantes
8.10.2. Récupération et entretien thermique
8.10.2. Hospitalisation et rétablissement rapide
8.10.3. Prévention de l'auto-traumatisme
8.10.4. Analgésie postopératoire
8.10.6. Traitement liquidien adéquat
8.10.7. Supplémentation nutritionnelle
Module 9. Pathologies et traitements médicaux
9.1. Traitements nutritionnels
9.1.1. Fluidothérapie: application clinique
9.1.1.1. Types de thérapie liquidienne
9.1.1.2. Avantages et inconvénients
9.1.2. Sonde d'alimentation et soutien nutritionnel
9.1.2.1. Besoins nutritionnels
9.1.2.2. Formules de nutrition entérique
9.2. Traitements externes
9.2.1. Taille des griffes et du bec
9.2.2. Réparation des plumes
9.2.2.1. Matériaux et instruments utilisés pour la greffe
9.2.2.2. Réparation des plumes pliées
9.2.2.3. Remplacement partiel de la plume
9.2.2.4. Remplacement total des plumes
9.2.3. Parage et rognage des ailes
9.2.4. Objectifs de la gestion du traitement des plaies
9.3.4.1. Soins des pansements
9.3.4.2. Retrait du pansement
9.3. Traitements des traumatismes
9.3.1. Pansements et bandages
9.3.1.1. Fonctions des pansements et des bandages
9.3.1.1.1. Protection
9.3.1.1.2. Pression
9.3.1.1.3. Soutien
9.3.1.1.4. Absorption, environnement humide, maintien en place
9.3.1.1.5. Confort
9.3.1.1.6. Autres caractéristiques d'un pansement idéal
9.3.1.2. Processus de sélection
9.3.1.3. Évaluation de la plaie
9.3.2. Types de pansements les plus couramment utilisés en chirurgie orthopédique
9.3.2.1. Bandage en forme de huit
9.3.2.2. Figure de huit et bandage corporel
9.3.2.3. Bandage ailé avec deux bandages circulaires autour du corps
9.3.2.4. Bandage Robert Jones
9.3.2.5. Bandage en boule
9.3.3. Plâtres de protection des jambes
9.3.4. Attelles externes
9.3.5. Cols élisabéthains
9.4. Administration de médicaments chez les oiseaux
9.4.1. Aspects pertinents de l'administration des médicaments
9.4.2. Routes d'utilisation
9.4.3. Avantages et inconvénients
9.4.4. Adaptation métabolique des médicaments
9.5. Antibiotiques les plus couramment utilisés chez le patient aviaire
9.5.1. Amikacin
9.5.1.1. Espèces indiquées et posologie
9.5.2. Ceftazidime
9.5.2.1. Espèces indiquées et posologie
9.5.3. Doxycycline
9.5.3.1. Espèce indiquée et dose efficace
9.5.4. Enrofloxacine et marbofloxacine
9.5.4.1. Les quinolones et leurs utilisations actuelles
9.5.5. Métronidazole
9.5.5.1. Espèce indiquée et dose efficace
9.5.6. Triméthoprime/sulfaméthoxazole
9.5.6.1. Dosage approprié
9.5.7. Autres antibiotiques utilisés
9.6. Antifongiques les plus couramment utilisés chez le patient aviaire
9.6.1. Amphotéricine B
9.6.1.1. Espèces cibles et dosage
9.6.2. Fluconazole
9.6.2.1. Dosage
9.6.3. Itraconazole
9.6.3.1. Dosage
9.6.4. Pour Ketoconazole: fongistatique
9.6.4.1. Dosage
9.6.5. Nystatine: antifongique de type macrolide
9.6.5.1. Espèces cibles et dosage
9.6.6. Autres antifongiques cliniquement pertinents
9.7. Les antiparasitaires les plus couramment utilisés chez le patient aviaire
9.7.1. Ivermectine
9.7.1.1. Espèces cibles et dosage
9.7.2. Albendazole
9.7.2.1. Espèces cibles et dosage
9.7.3. Fenbendazole
9.7.3.1. Espèces cibles et dosage
9.7.4. Levamisole
9.7.4.1. Type d'espèce et dosage
9.7.5. Sélamectine
9.7.5.1. Type d'espèce et dosage
9.7.6. Toltrazuril
9.7.6.1. Dosage et espèces cibles
9.7.7. Autres antiparasitaires cliniquement pertinents
9.8. Autres médicaments utilisés chez les oiseaux
9.8.1. Les antiviraux les plus couramment utilisés chez les oiseaux
9.8.1.1. Acyclovir
9.8.1.1.1. Posologie, espèces cibles et dosage
9.8.1.2. Autres antiviraux d'intérêt clinique
9.8.2. Hormones utilisées dans la volaille
9.8.2.1. Hormone adrénocorticotrope: ACTH
9.8.2.1.1. Type d'oiseau et dosage
9.8.2.2. Cabergoline
9.8.2.2.1. Dosage efficace
9.8.2.3. Oxytocine
9.8.2.3.1. Dosage efficace
9.8.2.4. Autres hormones cliniquement pertinentes
9.9. Médicaments utilisés pour la nébulisation
9.9.1. L'utilisation d'un nébuliseur
9.9.2. L'utilisation de F10
9.9.3. Gentamicine
9.9.4. Amikacin
9.9.4.1. Dosage et utilisation
9.9.5. Amphotéricine B
9.9.5.1. Dosage et utilisation
9.9.6. Clotrimazole
9.9.6.1. Dosage et utilisation
9.9.7. Autres médicaments utilisés pour la nébulisation
9.10. Collyres ophtalmologiques utilisés chez les oiseaux
9.10.1. Ciprofloxacine
9.10.2. Chloramphénicol
9.10.3. Tobramycine
9.10.4. Diclofenac
9.10.5. Prednisone
Module 10. Chirurgie orthopédique et ophtalmique chez les oiseaux
10.1. Ophtalmologie aviaire. Lésions des yeux et des paupières
10.1.1. Souvenirs anatomiques
10.1.2. Différences entre espèces
10.1.3. Physiopathologie du globe oculaire
10.1.4. Les traitements les plus couramment utilisés
10.2. Pododermatite. Les ongles
10.2.1. Caractéristiques de la pathologie
10.2.2. Espèces d'oiseaux les plus touchées
10.2.3. Traitements actuels
10.2.3.1. Traitement médical
10.2.3.2. Traitement chirurgical
10.2.3.2.1. Débridement nécrotique
10.2.4. Prévention
10.2.5. Traitement
10.3. Fractures. Perte de la définition de l'os
10.3.1. Le squelette des oiseaux
10.3.2. Matériel chirurgical requis et considérations techniques préliminaires
10.3.3. Examen physique et gestion préopératoire du patient aviaire
10.3.4. Types de fractures et de luxations des os
10.4. Correction des fractures. Objectifs du traitement des fractures
10.4.1. Techniques d'ostéosynthèse chez les oiseaux
10.4.1.1. Avantages
10.4.1.2. Inconvénients
10.4.2. Fixation interne
10.4.2.1. Verrouillage de la colonne vertébrale (intramédullaire ou centromédullaire)
10.4.2.2. Verrouillage
10.4.3. Fixation externe Échafaudages osseux
10.4.3.1. Fixateur de Kirschnner-Ehmer
10.5. Méthodes de fixation des fractures de l'humérus, de la clavicule et du coracoïde
10.5.1. Anatomie de la ceinture scapulaire et du membre antérieur
10.5.2. Fractures de l'humérus
10.5.3. Méthode de fixation pour les fractures distales et subcondyliennes de l'humérus
10.5.3.1. Fils croisés
10.6. Méthodes de fixation des fractures diaphysaires des membres antérieurs
10.6.1. Aspects pertinents
10.6.2. Placement de l'aiguille dans différents fixateurs
10.6.3. Fractures de la diaphyse proximale de l'ulna, avec radius intact ou fracturé
10.6.4. Fractures de la diaphyse cubitale et de la partie distale du cubitus, avec radius intact ou fracturé
10.6.5. Cas particuliers du membre antérieur
10.6.5.1. Fracture du radius proximale ou distale
10.6.5.2. Avec un ulna intact
10.6.6. Dislocations du coude
10.7. Méthodes de fixation du carpe et du tarse
10.7.1. Fixation de l'articulation du carpe
10.7.1.1. Aspects pertinents
10.7.1.2. Recommandations de traitement spécifiques
10.7.2. Fixation pour les fractures du tibiotarsus
10.7.2.1. Aspects pertinents
10.7.2.2. Les fractures du tibiotarse et leur stabilisation chirurgicale
10.7.3. Choix de fixation des fractures du tarso-métatarsien
10.8. Méthodes de fixation et pathologies orthopédiques du fémur
10.8.1. Aspects pertinents
10.8.2. Fractures du fémur
10.8.2.1. Stabilisation chirurgicale
10.8.3. Dislocation du genou
10.8.3.1. Traitement de choix
10.9. Lésions osseuses moins fréquentes
10.9.1. Dislocation et fracture du cou
10.9.1.1. Symptômes, diagnostic et traitement
10.9.2. Blessures de la quille
10.9.2.1. Pathologie
10.9.2.2. Traitement
10.9.3. Blessures à l'extrémité des ailes
10.9.3.1. Plaies et ulcères de l'aile
10.9.3.1.1. Types de plaies et traitement
10.9.3.2. Bursite
10.9.3.2.1. Symptômes et traitement
10.9.3.3. Œdème et syndrome de gangrène sèche: nécrose avasculaire
10.9.3.3.1. Localisation
10.9.3.3.2. Symptômes et traitement
10.10. Soins postopératoires des patients souffrant de fractures réparées
10.10.1. Physiothérapie pour le traitement des fractures de l'aile
10.10.2. Traitement du patagium
10.10.3. Réhabilitation physique et physiothérapie chez les volailles

Le matériel didactique de ce diplôme, élaboré par ces spécialistes, a un contenu tout à fait applicable à votre expérience professionnelle"
Mastère Spécialisé Hybride en Médecine et Chirurgie Aviaire
La médecine et la chirurgie aviaire est une spécialité fascinante qui gagne de plus en plus d'attention dans le monde vétérinaire. Si vous êtes vétérinaire et que vous êtes intéressé par ce domaine, TECH Global University vous présente le Mastère Spécialisé Hybride en Médecine et Chirurgie Aviaire, une excellente option pour vous. Ce programme d'études avancées se concentre sur les soins, le diagnostic et le traitement des oiseaux exotiques et sauvages. Le programme combine des sessions en ligne et en face à face, où vous aurez une expérience pratique des soins aux oiseaux dans un environnement contrôlé. Vous apprendrez l'anatomie et la physiologie des oiseaux, la médecine préventive, le diagnostic et le traitement des maladies, la nutrition, la réhabilitation et la gestion des oiseaux exotiques et sauvages.
De nos jours, l'intérêt pour les oiseaux exotiques et sauvages en tant qu'animaux de compagnie et d'exposition ne cesse de croître. Par conséquent, la demande de professionnels qualifiés dans le domaine des soins aux oiseaux augmente également. En outre, les oiseaux sont des animaux délicats qui nécessitent une approche spécialisée dans les soins et le traitement des maladies. Le Mastère Spécialisé Hybride proposé par TECH vous offre la flexibilité d'étudier à votre propre rythme depuis n'importe quel endroit disposant d'un accès à Internet, combiné à des cours pratiques dans un environnement en face-à-face. Une excellente option pour ceux qui cherchent à se spécialiser dans ce domaine fascinant et en constante évolution, profitez de cette grande opportunité et faites passer votre carrière au niveau supérieur avec TECH !







